Современная наука рассматривает старение не просто как хронологический процесс, а как совокупность биологических и молекулярных событий, изменяющих функционирование тканей с течением времени. Среди всех органов именно кожа – наиболее наглядный индикатор этих изменений. Она не только защищает организм от внешней среды, но и отражает внутренние метаболические и клеточные процессы, происходящие в теле. Именно поэтому изучение кожного старения становится ключом к пониманию общих закономерностей биологического старения человека [1].
Сегодня дерматология выходит далеко за рамки описания морфологических признаков старения и активно изучает молекулярно-генетические основы этих изменений. Особое внимание уделяется эпигенетическим механизмам, которые связывают влияние внешней среды с внутренними клеточными процессами и определяют, насколько «быстро» стареет кожа конкретного человека [2, 3].
Эпигенетические механизмы старения
Эпигенетические изменения включают три основных механизма:
- метилирование ДНК;
- модификации гистонов;
- регуляцию экспрессии генов с участием микроРНК.
Вместе они формируют динамическую сеть, управляющую активностью генов, участвующих в поддержании структуры и функции кожи [4].
Метилирование ДНК – наиболее изученная эпигенетическая метка. При старении происходят перестройки метильных паттернов в CpG-динуклеотидах, регулирующих активность генов. Ферменты ДНК-метилтрансферазы (DNMT1, DNMT3A, DNMT3B) добавляют метильные группы к цитозину, что обычно подавляет транскрипцию [5, 6]. Нарушение этого процесса приводит к гипер- или гипометилированию участков ДНК, меняя активность генов, ответственных за синтез коллагена, эластина, факторов роста и антиоксидантных ферментов [7]. Например, возрастное гиперметилирование гена COL1A1 снижает выработку коллагена I типа, что напрямую отражается на плотности и упругости кожи [8].
Модификации гистонов – еще один пласт регуляции. Ацетилирование гистонов (под действием HATs) способствует раскрытию хроматина и активации генов, тогда как деацетилирование (под влиянием HDACs) – наоборот, его уплотняет и тормозит транскрипцию. При фотостарении увеличивается ацетилирование гистона H3 и снижается активность HDAC4 и HDAC11, что усиливает разрушение коллагена через активацию MMPs [9, 10].
МикроРНК (miRNA) – короткие некодирующие РНК, регулирующие экспрессию сотен генов. Например, снижение уровня miR-146a ассоциируется с уменьшением пролиферации фибробластов и накоплением повреждений ДНК [11]. Между микроРНК, метилированием и модификацией гистонов существует сложная двунаправленная связь: изменения в одном механизме отражаются на другом [12, 13].
Эти процессы способствуют формированию секреторного фенотипа, ассоциированного со старением (SASP) – своеобразного воспалительного профиля клеток, включающего цитокины, хемокины и протеазы [14]. SASP лежит в основе феномена inflammaging (inflammation – воспаление, aging – старение) – хронического стерильного воспаления низкой интенсивности, характерного для стареющей кожи [15]. При этом умеренная активность SASP играет и положительную роль, участвуя в регенерации тканей и удалении поврежденных клеток [16].
Несмотря на устойчивость эпигенома [4], именно на этом уровне возможна частичная «перепрограммировка» клеток – т.е. обращение возрастных изменений. Поэтому интерес к эпигенетическим биомаркерам в дерматологии стремительно растет. Модели «эпигенетических часов» позволяют объективно оценить биологический возраст кожи и отслеживать эффект различных вмешательств [17, 18].
Геропротекторы – секрет клеточной молодости?
Доказано, что лазерные, радиочастотные и ультразвуковые процедуры способны модулировать эпигенетические процессы, включая метилирование ДНК и экспрессию генов, отвечающих за синтез коллагена [19–22].
Однако активно изучаются химические соединения с антивозрастными свойствами – геропротекторы [23–25]. Среди них выделяются несколько ключевых групп:
- Предшественники НАД+ (никотинамид, никотинамидмононуклеотид, никотинамидрибозид) поддерживают активность сиртуинов – ферментов, отвечающих за стабильность хроматина и энергетический баланс клеток. Их применение способствует восстановлению митохондрий и защите фибробластов от окислительного стресса [26].
- Ингибиторы HDAC (например, субероиланилид гидроксамовой кислоты) уменьшают воспаление, тормозят фиброз и эпидермальную гиперплазию, поддерживая водный баланс и плотность кожи [27].
- Метформин и рапамицин воздействуют на сигнальные пути нуклеарного фактора и процессы метилирования гистонов, снижая воспаление и поддерживая структуру внеклеточного матрикса [28, 29].
- Ретиноиды регулируют экспрессию генов, отвечающих за обновление клеток, синтез коллагена и снижение пигментации [30].
- Полисахариды (в частности, β-глюкан) оказывают иммуномодулирующее и антиоксидантное действие, влияя на метилирование гистонов и структуру ДНК [31].
- Сеноморфные пептиды, такие как Pep 14, избирательно воздействуют на стареющие клетки, стимулируя регенерацию тканей и повышая плотность эпидермиса [32].
- Полифенолы и фитоэстрогены проявляют выраженную антиоксидантную активность, поддерживают синтез коллагена и гиалуроновой кислоты, защищают ДНК от окислительного повреждения и регулируют метилирование [33, 34].
Особый интерес вызывает эпицеллин (дигидромирицетин) – флавоноид из листьев Ampelopsis grossedentata, который способен ингибировать активность DNMT1. Действие эпицеллина обусловлено модуляцией экспрессии генов, участвующих в процессах старения, модификацией эпигенетического метилирования ДНК и индукцией регенеративных процессов в клетках дермы и эпидермиса.
Наружное применение эпицеллина также продемонстрировало влияние на связанное с возрастом подавление экспрессии генов in vivo. Данный эффект зафиксирован для генов, участвующих в различных биологических процессах, что свидетельствует о его комплексном воздействии на механизмы старения кожи [35].
В этом контексте особый интерес представляет эпигенетический уход за кожей как область исследований, нацеленная на создание топических средств, способных влиять на экспрессию генов с целью профилактики старения кожи [24].
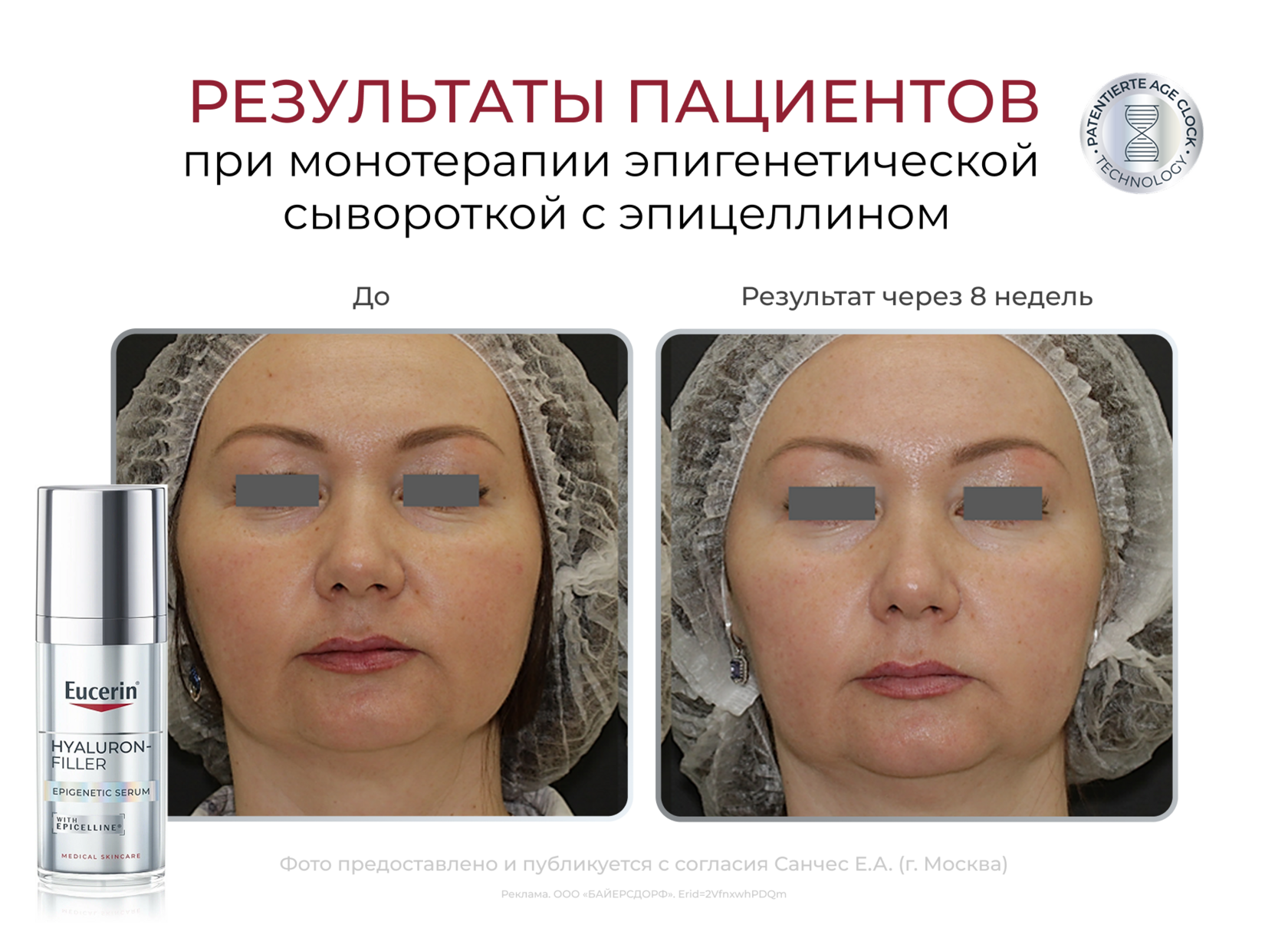
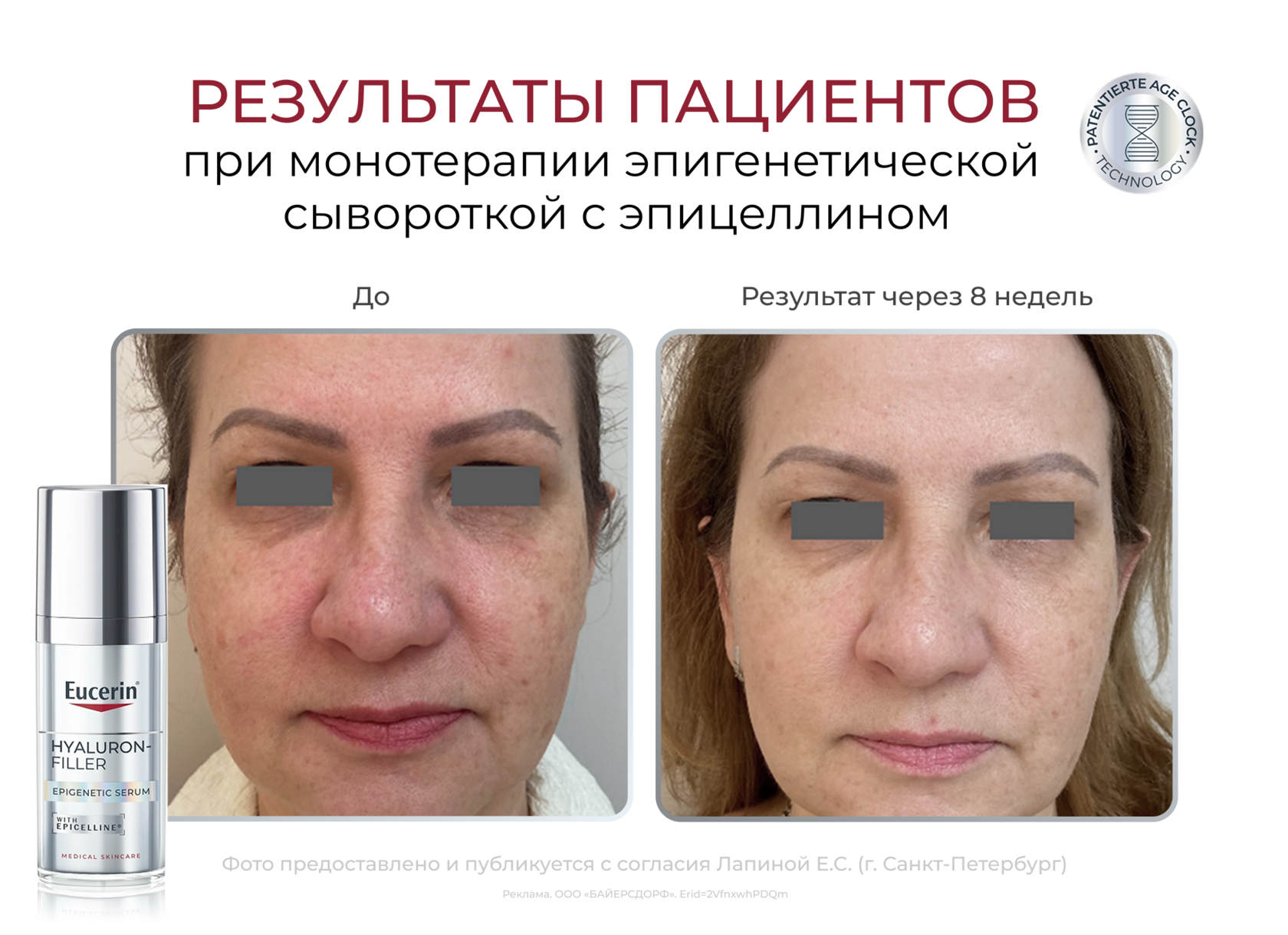
В 2025 г. в Москве и Санкт-Петербурге проведено клиническое исследование сыворотки с эпицеллином*, включавшее 175 пациентов. По результатам исследования 90% пациентов отметили очень хорошую и хорошую переносимость сыворотки (8% – как нормальную, 2% – как удовлетворительную). Через 8 нед применения сыворотка с эпицеллином значительно выравнивает тон и текстуру кожи, разглаживает мелкие морщины, придает гладкость и сияние, за счет чего позволяет пациентам выглядеть моложе.
Новая парадигма антивозрастной дерматологии
Эпигенетика старения кожи — это не просто научное направление, а новая философия эстетической медицины. Она объединяет клеточную биологию, молекулярную генетику и клиническую дерматологию, формируя основу для персонализированного ухода и профилактики возрастных изменений.
Понимание эпигенетических механизмов старения кожи меняет саму концепцию anti-age терапии. Если раньше коррекция сводилась к устранению внешних признаков старения, то сегодня акцент смещается к воздействию на первопричины – регуляцию экспрессии генов, поддержание клеточного гомеостаза и предотвращение хронического воспаления.
Материал подготовлен на основе статьи: Тлиш ММ, Шавилова МЕ. Эпигенетика старения кожи: от механизмов к поиску способов коррекции. Медицинский совет. 2025;19(14):193-200. https://doi.org/10.21518/ms2025-338.
Список литературы
1. Cohen AA, Ferrucci L, Fülöp T, Gravel D, Hao N, Kriete A et al. A complex systems approach to aging biology. Nat Aging. 2022;2(7):580–591. https://doi.org/10.1038/s43587-022-00252-6
2. Wang K, Liu H, Hu Q, et al. Epigenetic regulation of aging: implications for interventions of aging and diseases. Sig Transduct Target Ther. 2022;7:374. https://doi.org/10.1038/s41392-022-01211-8
3. Cai Y, Song W, Li J, et al. The landscape of aging. Sci China Life Sci. 2022;65(12):2354–-454. https://doi.org/10.1007/s11427-022-2161-3
4. Grönniger E, Max H, Lyko F. Skin Rejuvenation by Modulation of DNA Methylation. Exp Dermatol. 2024;33(10):e70005. https://doi.org/10.1111/exd.70005
5. Adhikari S, Curtis PD. DNA methyltransferases and epigenetic regulation in bacteria. FEMS Microbiol Rev. 2016;40(5):575-91. https://doi.org/10.1093/femsre/fuw023
6. Li Y, Zhang Z, Chen J, et al. Stella safeguards the oocyte methylome by preventing de novo methylation mediated by DNMT1. Nature. 2018;564:136-40. https://doi.org/10.1038/s41586-018-0751-5
7. Grönniger E, Weber B, Heil O, et al. Aging and chronic sun exposure cause distinct epigenetic changes in human skin. PLoS Genetics. 2010;6(5):e1000971. https://doi.org/10.1371/journal.pgen.1000971
8. Liamry JN, Humardani F, Chandra G, et al. Exploring the impact of diabetes on aging: insights from TERT and COL1A1 methylation. Turk J Biol. 2024;48(4):257-66. https://doi.org/10.55730/1300-0152.2701
9. Shin N-H, Trang DT, Hong W-J, et al. Increased histone acetylation and decreased expression of specific histone deacetylases in ultraviolet-irradiated and intrinsically aged human skin in vivo. Int J Mol Sci. 2020;21(1):260. https://doi.org/10.3390/ijms21010260
10. Bielach-Bazyluk A, Zbroch E, Mysliwiec H, et al. Sirtuin 1 and Skin: Implications in Intrinsic and Extrinsic Aging – A Systematic Review. Cells. 2021;10(4):813. https://doi.org/10.3390/cells10040813
11. Stafa K, Rella A, Eagle W, et al. miR-146a is a critical target associated with multiple biological pathways of skin aging. Front Physiol. 2024;15:1291344. https://doi.org/10.3389/fphys.2024.1291344
12. Dermitzakis I, Kyriakoudi SA, Chatzianagnosti S, et al. Epigenetics in skin homeostasis and ageing. Epigenomes. 2025;9(1):3. https://doi.org/10.3390/epigenomes9010003
13. Morales S, Monzo M, Navarro A. Epigenetic regulation mechanisms of microRNA expression. Biomol Concepts. 2017;8(5-6): 203-12. https://doi.org/10.1515/bmc-2017-0024
14. Dasgupta N, Arnold R, Equey A, et al. The role of the dynamic epigenetic landscape in senescence: orchestrating SASP expression. NPJ Aging. 2024;10:48. https://doi.org/10.1038/s41514-024-00172-2
15. Chin T, Lee XE, Ng PY, et al.The role of cellular senescence in skin aging and age-related skin pathologies. Front Physiol. 2023;14:1297637. https://doi.org/10.3389/fphys.2023.1297637
16. Birch J, Gil J. Senescence and the SASP: many therapeutic avenues. Genes Dev. 2020;34:1565-76. https://doi.org/10.1101/gad.343129.120
17. Horvath S. DNA methylation age of human tissues and cell types. Genome Biol. 2013;14(10):3156. https://doi.org/10.1186/gb-2013-14-10-r115
18. Boroni M, Zonari A, Oliveira C, et al. Highly accurate skin-specific methylome analysis algorithm as a platform to screen and validate therapeutics for healthy aging. Clin Epigenetics. 2020;12(1):1-16. https://doi.org/10.1186/s13148-020-00899-1
19 Haykal D, Flament F, Mora P, et al. Unlocking Longevity in Aesthetic Dermatology: Epigenetics, Aging, and Personalized Care. Int J Dermatol. 2025. https://doi.org/10.1111/ijd.17725
20. Haykal D, Will F, Cartier H, Dahan S. Epigenetic Modifications and the Role of Medical Lasers in Enhancing Skin Regeneration. Int J Dermatol. 2025;24(1):16780. https://doi.org/10.1111/jocd.16780
21. Тлиш М.М., Сашко М.И., Шавилова М.Е., Псавок Ф.А. Возможности комбинированного калий-титанилфосфатного и неодимового (КТР 532 нм и Nd:YAG 1064 нм) лазерного излучения в комплексной терапии акне. Лечащий врач. 2022;11(25):11-5 [Tlish MM, Sashko MI, Shavilova ME, Psavok FA. Possibilities of combined (KTP 532 nm and Nd: YAG 1064 nm) laser radiation in complex acne therapy. Lechaschi Vrach. 2022;11(25):11-5 (in Russian)]. https://doi.org/10.51793/OS.2022.25.11.002
22. Kokikian N, Arenzo J, Gasilla J, et al. 857 Fractional non-ablative laser has a divergent impact on molecular markers of aging. J Invest Dermatol. 2024;144(8):S149. https://doi.org/10.1016/j.jid.2024.06.873
23. Dal Pozzo L, Xu Z, Lin S, et al. Role of epigenetics in the regulation of skin aging and geroprotective intervention: a new sight. Biomed Pharmacother. 2024;174:116592. https://doi.org/10.1016/j.biopha.2024.116592
24. Minoretti P, Emanuele E. Clinically Actionable Topical Strategies for Addressing the Hallmarks of Skin Aging: A Primer for Aesthetic Medicine Practitioners. Cureus. 2024;16(1):e52548. https://doi.org/10.7759/cureus.52548
25. Moskalev A, Chernyagina E, de Magalhães JP, et al. Geroprotectors.org: a new, structured and curated database of current therapeutic interventions in aging and age-related disease. Aging. 2015;7(9):616-28. https://doi.org/10.18632/aging.100799
26. Oblong JE. The evolving role of the NAD+/nicotinamide metabolome in skin homeostasis, cellular bioenergetics, and aging. DNA Repair. 2014;23:59-63. https://doi.org/10.1016/j.dnarep.2014.04.005
27. Majora M, Sondenheimer K, Knechten M, et al. HDAC inhibition improves autophagic and lysosomal function to prevent loss of subcutaneous fat in a mouse model of Cockayne syndrome. Sci Transl Med. 2018;10(456):eaam7510. https://doi.org/10.1126/scitranslmed.aam7510
28. Gouveri E, Papanas N. Τhe endless beauty of metformin: does it also protect from skin aging? A narrative review. Adv Ther. 2023;40(4):1347-56. https://doi.org/10.1007/s12325-023-02434-z
29. Chung CL, Lawrence I, Hoffman M, et al. Topical rapamycin reduces markers of senescence and aging in human skin: an exploratory, prospective, randomized trial. GeroScience. 2019;41(6):861-9. https://doi.org/10.1007/s11357-019-00113-y
30. Quan T. Human Skin Aging and the Anti-Aging Properties of Retinol. Biomolecules. 2023;13(11):1614. https://doi.org/10.3390/biom13111614
31. Feng X, Shang J, Wang Y, et al. Exploring the Properties and Application Potential of β‐Glucan in Skin Care. Food Sci Nutr. 2025;13(4):e70212. https://doi.org/10.1002/fsn3.70212
32. Zonari A, Brace LE, Al-Katib K, et al. Senotherapeutic peptide treatment reduces biological age and senescence burden in human skin models. NPJ Aging. 2023;9(1):10. https://doi.org/10.1038/s41514-023-00109-1
33. Jacczak B, Rubis B, Totoń E. Potential of Naturally Derived Compounds in Telomerase and Telomere Modulation in Skin Senescence and Aging. Int J Mol Sci. 2021;22(12):6381. https://doi.org/10.3390/ijms22126381
34. Tarwadi KV, Agte VV. Effect of micronutrients on methylglyoxal-mediated in vitro glycation of albumin. Biol Trace Elem Res. 2011;143(2):717-25. https://doi.org/10.1007/s12011-010-8915-7
35. Falckenhayn C, Bienkowska A, Söhle J, et al. Identification of dihydromyricetin as a natural DNA methylation inhibitor with rejuvenating activity in human skin. Front Aging. 2024;4:1258184. https://doi.org/10.3389/fragi.2023.1258184